와이즈컴퍼니㈜는 다년간에 축적된 FDA 및 CE 인허가 데이터를 바탕으로 De Novo 인증 절차 지도를 수행합니다.
1. De Novo classification Request
의료기기의 위험도가 Class I 또는 Class II에 해당하지만, Predicate device(FDA 기허가된 의료기기)가 없거나 Predicate device와 사용목적 및 작용원리가 다른 새로운 기기(Novel medical devices)의 의도된 사용에 따른 안전 및 유효성을 입증하고, 예측되는 위험들을 통제하는 방법을 설정하여 새로운 Product code를 수립하여 진행되는 인증 절차입니다.
De novo 절차는 다음 2가지 경우에 신청할 수 있습니다.
- 510(k) 제출 후에 Predicate device가 없거나, 새로운 사용목적, 새로운 기술을 가진 이유로 NSE 결정된 경우
- 신청자가 인증 대상기기가 Class I or Class II 이에 적합하다고 판단되나, 유사한 Product code 또는 Predicate device가 없다고 결정한 경우
2. De Novo 절차 및 필요자료
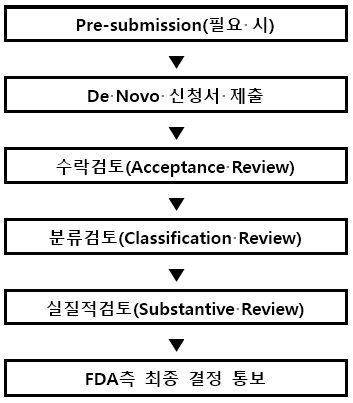
2-1. Pre-submission
510(k) 절차 없이 바로 De Novo를 진행(Direct De Novo) 시 Pre-submission이 권고되며, FDA측으로 제품이 De Novo 절차에 적합한지, 안전 및 유효성을 검증하기 위한 심사자료들이 충분한 근거로 작용할 수 있는지, 설정한 법률적 규제들(regulatory controls)이 적절한지 등 제품 개발단계부터 De Novo 절차준비에 관련된 사항이 잘 진행되고 있는지 FDA측의 의견을 들어볼 수 있습니다.
2-2. 신청서 제출 및 수락, 검토 (Acceptance Review)
실질적 검토(Substantive review)를 위해 관련자료의 구비가 완료되었는지 검토하고(약, 15일 소요) 추가로 확인이 필요한 정보 및 문서가 있다면 RTA letter가 발행되며 보완자료를 180일 이내로 송부하도록 요청합니다.
2-3. 분류 검토 (Classification Review)
실질적 검토(Substantive Review)를 위한 제출자료의 준비가 완료되면, FDA는 Predicate device가 존재하는지, 대상기기가 class III에 해당하지는 않는지, 유사한 제품이 이미 PMA로 진행되고 있는지를 확인하게 되며, 이 중 하나라도 해당될 경우 De Novo classification Request를 거절 및 종료됩니다.
따라서 신청하시는 제품이 이전 분류된 적이 없었던 새로운 제품임을 입증할 자료를 철저히 준비하셔야 합니다. 특히, 이전 제품분류에 대한 FDA측의 의견을 전달받지 못하는 Direct De novo의 경우 해당 자료 준비가 더욱 중요합니다.
2-4. 실질적 검토 (Substantive Review)
대상기기가 De novo Classification에 부합하면, FDA는 실질적 검토를 진행되며, 이때 모든 제출된 자료를 세부적으로 검토하며 결함(deficiency)이 있는지 확인하게 됩니다. 보완 요청은 Interactive review 혹은 Additional Information letter 형식으로 진행될 수 있으며, Additional Information letter 에 명시된 결함은 반드시 180일 이내에 해결되어 관련 입증 자료를 제출해야 합니다. 다음 이유로 FDA는 대상시설의 감사를 요청할 수 있습니다.
- De novo 진행 중 임상 및 비임상 자료가 신뢰성 있게 수집되었는지 판단
- 대상기기의 제조가 안전하고 유효하게 제조되는지 판단
- 제조자의 품질경영시스템이 QSR (21CFR Part 820)에 준수되는지 판단.
2-5. 심사결과 전달
FDA는 De Novo 요청이 승인(Grant) 또는 거절(Decline)되었음을 신청자에게 통보합니다.
1) 승인 시- 새로운 Product code와 Class II인 경우 해당되는 특별규제를 규정합니다.
- 승인 후 30일 이내에 장치의 분류 및 적용가능한 요건을 코드화 하여 공고합니다.
- 근거와 함께 De novo 요청이 거절 되며, 절차가 종결됩니다.
U.S. De novo 관련 문의사항은 연락처의 정보로 문의 주시기 바랍니다.