국내 의료기기 인허가
V. 식품의약품안전처(MFDS) 의료기기 2등급 제조(수입)인증 및 허가
하기의 정보는 『의료기기법』(법률 제13116호), 『의료기기법시행령』(대통령령 제263375호), 『의료기기법시행규칙』(총리령 제1181호), 『의료기기 허가 신고 심사 등에 관한 규정』(고시 제2015-46호)에 의거하여 작성되었다.
- 근거 법령
“의료기기법” 제6조/제7조/제15조 및 같은 법 시행규칙 제4조/제6조/제8조/제9조/제30조/제31조
- 허가 대상
의료기기 2등급 제조(수입) 인증 및 허가를 받고자 하는 자
- 의료기기 2,3,4 등급 제조(수입) 인증 및 허가 업무 흐름도
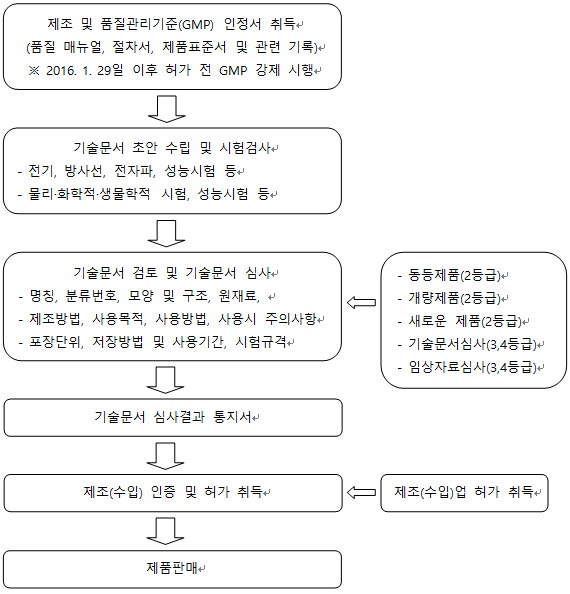
4. 의료기기 2등급 허가 처리 흐름도
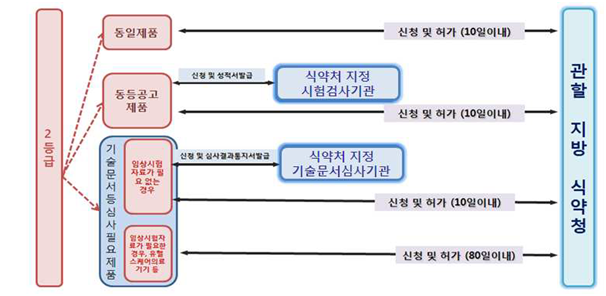
<출처: 의료기기 제조(수입) 허가•신고•심사 등 민원처리 안내서>
- 구비서류
1) 동일제품: 이미 허가 받은 품목과 동일한 제조원(제조국가, 제조회사 및 제조소)의 동일 제품
① 의료기기 제조(수입) 인증/허가신청서(의료기기법시행규칙 별지 제3/5호 서식)
② 기허가 제품의 기술문서에 준하는 자료
③ 품목이나 동일품목군의 의료기기 제조 및 품질관리 기준(GMP) 적합인정서 사본
※ “의료기기법” 제6조4항에 의거해 2016. 1. 29일 이후 제조허가 또는 제조인증을 받거 나 제조신고를 하려는 자는 필요한 시설과 제조 및 품질관리체계를 미리 갖추어 허가 또는 인증을 신청하거나 신고하여야 한다
④ 제조•판매증명서, 제품안내서
⑤ 제조원 증명서(공증)
2) 동등, 개량, 새로운 제품 및 동등공고제품 (2등급)
- 임상시험자료가 필요 없는 제품
① 의료기기 제조(수입) 인증/허가신청서(의료기기법시행규칙 별지 제3/5호 서식)
② 기술문서 등의 심사 결과 통지서
※ 의료기기 기술문서 심사기관의 발행일로부터 2년이 경과되지 아니한 것
③ 품목이나 동일품목군의 의료기기 제조 및 품질관리 기준(GMP) 적합인정서 사본
※ “의료기기법” 제6조4항에 의거해 2016. 1. 29일 이후 제조허가 또는 제조인증을 받거 나 제조신고를 하려는 자는 필요한 시설과 제조 및 품질관리체계를 미리 갖추어 허가 또는 인증을 신청하거나 신고하여야 한다
④ 수탁자 조건 증명 서류 (전공정위탁 대상인 경우에 한함)
- 임상시험자료가 필요한 제품 또는 의료기기 기술문서 심사기관의 심사 품목에서 제외된 제품(관할 지방청에 일괄 허가 신청)
① 의료기기 제조(수입) 인증/허가신청서(의료기기법시행규칙 별지 제3/5호 서식)
② 일괄검토의 경우 기술문서 검토자료 및 허가신청 구비서류 전체
③ 품목이나 동일품목군의 의료기기 제조 및 품질관리 기준(GMP) 적합인정서 사본
※ “의료기기법” 제6조4항에 의거해 2016. 1. 29일 이후 제조허가 또는 제조인증을 받거 나 제조신고를 하려는 자는 필요한 시설과 제조 및 품질관리체계를 미리 갖추어 허가 또는 인증을 신청하거나 신고하여야 한다
④ 수탁자 조건 증명 서류 (전공정위탁 대상인 경우에 한함)
<임상시험자료가 필요 없는 제품 및 필요한 제품>
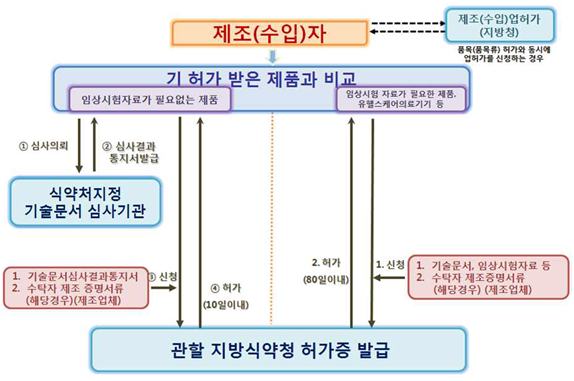
<출처: 의료기기 제조(수입) 허가•신고•심사 등 민원처리 안내서>
3) 동등공고제품
① 의료기기 제조(수입) 인증/허가신청서(의료기기법시행규칙 별지 제3/5호 서식)
② 식약처장이 지정한 시험검사기관이 발행한 시험검사성적서
※ 동등공고제품에 적합함을 증명하는 시험성적서
※ 식약처장이 지정한 시험검사기관에서 발행한 시험성적서
③ 품목이나 동일품목군의 의료기기 제조 및 품질관리 기준(GMP) 적합인정서 사본
※ “의료기기법” 제6조4항에 의거해 2016. 1. 29일 이후 제조허가 또는 제조인증을 받거 나 제조신고를 하려는 자는 필요한 시설과 제조 및 품질관리체계를 미리 갖추어 허가 또는 인증을 신청하거나 신고하여야 한다.
④ 수탁자 조건 증명 서류(전공정위탁 대상인 경우에 한함)
⑤ 본질적동등품목 비교표
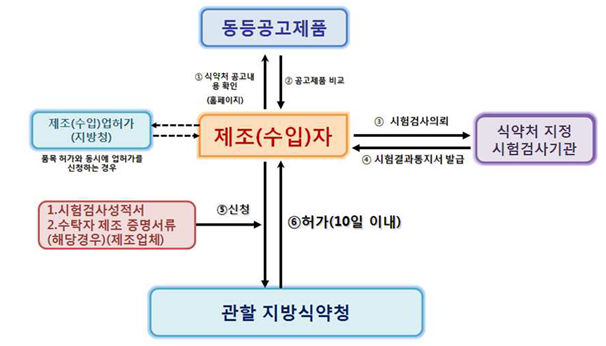
<출처: 의료기기 제조(수입) 허가•신고•심사 등 민원처리 안내서>
- 허가 기관
식품의약품안전처 (Ministry of Food and Drug Safety)
관할지방식약청
의료기기정보기술지원센터
- 처리 기간
임상시험 검토대상 : 80일
기술문서 검토대상 : 65일
기술문서 등 심사불필요 : 10일
국내 의료기기 허가 관련 문의사항은 연락처의 정보로 문의 주시기 바랍니다.