국내 의료기기 인허가
IV. 식품의약품안전처(MFDS) 의료기기 제조(수입) 신고 및 변경신고
하기의 정보는 『의료기기법』(법률 제13116호), 『의료기기법시행령』(대통령령 제263375호), 『의료기기법시행규칙』(총리령 제1181호), 『의료기기 허가 신고 심사 등에 관한 규정』(고시 제 2015-46호)에 의거하여 작성되었다.
- 제조(수입) 신고 – 1등급 의료기기
1) 근거 법령
“의료기기법” 제6조/제7조 및 동법시행규칙 제7조
2) 신청 및 구비서류
(1) 1등급 의료기기
① 신청: 의료기기 전자민원창구 등록
② 구비서류
ㄱ. 신고서(의료기기시행규칙 별지 제7호 서식)
ㄴ. 사용목적 등(‘의료기기 품목 및 품목별 등급에 관한 규정’ 별표1에 따라 작 성)
ㄷ. 전공정 위탁의 경우: 수탁자 조건 증명 서류(제조공정을 전부 위탁받을 수 있는 자에 해당하는지를 증명할 수 있는 서류)
ㄹ. 품목류 신고대상의 경우: 제조(수입) 신고 시 신고서의 “품목류” 란에 표기
※ 1등급 중 이미 허가를 받거나 신고한 품목과 구조, 원리, 성능, 사용목적 및
사용방법 등이 본질적으로 동등하지 않은 의료기기는 식약처에 허가 신청 하여야 한다.
(2) 1등급 체외진단용 의료기기
① 신청: 의료기기 전자민원창구 등록
② 구비서류
ㄱ. 사용목적 등(‘검사대상, 검체정루, 검사항목, 측정원리 및 정성 또는 정량 등을 구체 적으로 작성)
3) 허가 기관
식품의약품안전처(Ministry of Food and Drug Safety)
의료기기정보기술지원센터
4) 처리 기간
전자민원시스템상에 등록이 완료된 시점
- 제조(수입) 변경신고 – 1등급 의료기기
1) 근거 법령
“의료기기법” 제12조/제15조 및 동법시행규칙 제26조
2) 신청 및 구비서류
(1) 1등급 의료기기
① 신청: 의료기기 전자민원창구 등록
② 구비서류
ㄱ. 신고서(의료기기시행규칙 별지 제7호 서식)
ㄴ. 전공정 위탁의 경우: 수탁자 조건 증명 서류(제조공정을 전부 위탁 받을 수 있는 자에 해당하는지를 증명할 수 있는 서류)
ㄷ. 일반적인 변경인 경우: 제조(수입)신고한 제품에 변경이 발생한 경우 경미한 Kor_Changes으로 ‘경미한 Kor_Changes 보고서’를 첨부하여 변경이 있 는 날부터 30일 이내 또는 매년 최초 허가 또는 신고일의 전월 말일부 터 역산하여 1년 동안의 변경 내용에 대하여 허가 또는 신고일이 속하 는 월의 말일까지 관할 지방식약청장에게 제출
(※의료기기 전자민원사이트에 등록 변경하는 경우 변경신고된 것 으로 봄)
※ 반드시 30일 이내 보고하여야 하는 변경
- 생산 및 수입 중단에 따른 일부 모델명의 삭제
- 경미한 변경에 따른 모델명의 변경 또는 추가
- 상호변경에 따른 제조원 명칭변경 및 제품명 변경
- 수입 의료기기의 수출국 제조자 소재지 변경
ㄹ. 양도양수에 의한 변경인 경우: 경미한 변경 수시보고로 처리
※ 양도양수에 의한 경미한 변경보고 처리 시, 제조원 명칭 및 제품명 변경이 함께 처리되고 양도양수계약서(원본) 제출이 요구된다.
③ 새로운 신고 대상
- 사용목적의 변경
- 작용원리의 변경으로 인한 기 신고사항의 변경
<1등급 의료기기 신고처리 업무 흐름도>
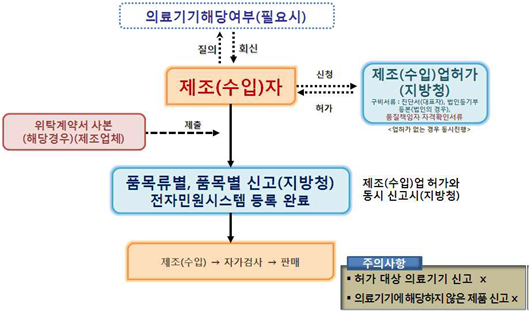
<출처: 의료기기 제조(수입) 허가•신고•심사 등 민원처리 안내서>
3) 허가 기관
식품의약품안전처(Ministry of Food and Drug Safety)
의료기기정보기술지원센터
4) 처리 기간
전자민원시스템상에 경미한 변경보고 한 시점
국내 의료기기 허가 관련 문의사항은 연락처의 정보로 문의 주시기 바랍니다.